- ¿Qué es la listeriosis y
cómo se diagnostica?
Es una enfermedad causada por
la bacteria Listeria monocytogenes.
Es una patología poco
frecuente y suele ser asintomática o cursar con una sintomatología
gastrointestinal leve y fiebre alta. En algunos grupos de riesgo específicos,
sobre todo en inmunodeprimidos, personas de edad avanzada, niños y embarazadas,
puede presentar cuadros graves que incluyen meningitis, septicemia y abortos o
partos pre término.
Los síntomas suelen aparecer
entre 2 y 3 semanas tras la infección, aunque pueden hacerlo desde uno hasta 70
días tras la infección.
Se diagnostica con un análisis
de sangre.
- ¿Existe riesgo de que
aparezcan más casos?
Sí, dado que el periodo de
incubación de la listeriosis puede ser de hasta 70 días, aunque la mayor parte
deberían identificarse en las 2-3 semanas tras la retirada del producto del
mercado (el 16 de agosto).
- ¿Hay todavía productos con
listeria en el mercado?
Pese a la orden de retirada de
todos los productos emitida el 16 de agosto, parte de los lotes afectados ya
habían llegado a los consumidores, por lo que esa posibilidad no se puede
descartar.
- ¿Qué debo hacer si tengo el
producto en casa?
No consumirlo y devolverlo al
punto de compra o desecharlo.
Si ha consumido el producto
debe prestar atención a la aparición de síntomas; si estos se presentan, acudir
al médico inmediatamente.
- Estoy embarazada y he comido
¿qué debo hacer?
Acudir a su médico aun en
ausencia de síntomas para que pueda valorar la situación y, de ser necesario,
recomendar medidas de prevención adicionales.
- He oído que no se debe
consumir ningún derivado del cerdo, ¿es cierto?
No.
- ¿Cómo se transmite la
listeriosis?
Fundamentalmente al comer
alimentos contaminados con listeria.
Otra vía de contagio es de
madre a hijo, a través de la placenta o durante el parto. No se transmite de
persona a persona.
- ¿Qué alimentos pueden ser
responsables de producir la enfermedad?
Cualquier alimento listo para
el consumo que no requiera un cocinado previo para su consumo inmediato y que
esté contaminado con listeria puede estar implicado en la transmisión de la
enfermedad. La bacteria de la listeria es capaz de sobrevivir en medios ácidos,
con altas concentraciones de sal y puede crecer a bajas temperaturas, incluso
por debajo de la temperatura de refrigeración.
Los alimentos más
frecuentemente asociados con la listeriosis son productos cárnicos envasados,
productos de la pesca ahumados, ensaladas y frutas preparadas y envasadas,
patés refrigerados, leche cruda y quesos frescos o de pasta blanda elaborados
con leche cruda.
- ¿Cuáles son las medidas
básicas para evitar el contagio?
Cocinar a temperaturas
superiores a 70°C mata las bacterias. También es importante mantener baja la
temperatura de los frigoríficos para limitar su crecimiento, por debajo de los
4ºC.
Para evitar riesgos de
contaminación cruzada desde productos contaminados a otros alimentos, es
importante garantizar una correcta higiene en superficies y utensilios que
puedan entrar en contacto con ellos.
Las mujeres embarazadas,
personas de edad avanzada, niños y las personas inmunodeprimidas deben consumir
solo carnes perfectamente cocinadas y productos lácteos pasteurizados, además
de calentar las sobras de comida a una temperatura por encima de los 70ºC.
También deben evitar alimentos preparados listos para el consumo frecuentemente
asociados con la listeriosis.
- ¿Qué personas tienen mayor
riesgo de sufrir la enfermedad?
El riesgo de que aparezca
enfermedad grave es mayor en niños, ancianos, embarazadas e inmunodeprimidos.
Por ello, si pertenece a uno de estos grupos y sospecha que ha consumido un
producto contaminado, es recomendable acudir al médico para que se pueda
valorar el riesgo de manera adecuada.
- ¿Existe tratamiento para la
listeriosis?
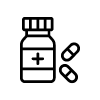
Sí, la listeriosis responde
bien al tratamiento con antibióticos.

 Los anticuerpos, el complemento y la citotoxicidad celular dependiente de anticuerpos también facilitan la eliminación del virus y la inducción de la inmunopatología
Los anticuerpos, el complemento y la citotoxicidad celular dependiente de anticuerpos también facilitan la eliminación del virus y la inducción de la inmunopatología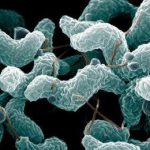




 Alimentos listos para su consumo que contengan pollo poco cocinado
Alimentos listos para su consumo que contengan pollo poco cocinado



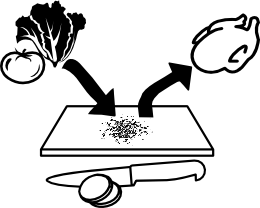
 Mantener la limpieza con la consiguiente desinfección de las superficies, utensilios y tablas para cortar.
Mantener la limpieza con la consiguiente desinfección de las superficies, utensilios y tablas para cortar. C
C
 Evitar lavar la carne cruda
Evitar lavar la carne cruda Evitar el uso de agua de manantial/pozo para beber o preparar alimentos
Evitar el uso de agua de manantial/pozo para beber o preparar alimentos